Antibiotika
Von griechisch ‚anti‘ (= gegen) und ‚biotikos‘ (= lebensfähig).
Der Anfang: Penicillin
Die Entdeckung des ersten antimikrobiellen Wirkstoffes entsprang einem Experiment, dem der Zufall – so zumindest die immer wieder kolportierte Mär – die entscheidende Wendung gab. Im Jahre 1928 kehrte Alexander Fleming von einem längerem Ausflug in die Berge ins Labor zurück, wo er beobachtete, dass einige seiner Bakterien-Kulturen mit einem Pilz kontaminiert waren.
 Ein einfach zu wiederholendes Experiment, was ich zufällig in meinem Kühlschrank bestätigt sah. (Ich hab‘ nicht extra danach suchen müssen) Fleming unterzog die Zell-Kulturen einer eingehenden Untersuchung, wobei sich herausstellte, dass der Pilz, penicillinum notatum, die Zellwände der Bakterien zerstört und damit die Ausbreitung der Bakterien verhindert hatte. Es ist wohl wahrscheinlich, dass Fleming die Ergebnisse von Ernest Duchesne kannte, der bereits 1897 in seiner Doktorarbeit unter anderem die Wechselwirkung zwischen E.coli und Penicillinum glaucum untersucht hatte. Er konnte schon damals die antimikrobielle Wirkung des Pilzes auf Bakterien-Kulturen und mit Typhus infizierten Tieren nachweisen. Der Eintritt ins Militär und eine tödliche Tuberkulose-Infektion verhinderten eine frühere Identifikation des Wirkstoffes. Fleming hingegen gelang der Nachweis, dass ein Produkt des Pilzes für die bakterizide Wirkung verantwortlich war, das er nach dem Schimmelpilz Penicillin benannte. Gleichwohl sollte es weitere 10 Jahre dauern, ehe es gelang aus dem Wirkstoff ein wirkungsvolles Medikament in industriellem Maßstab zu gewinnen. Der II. Weltkrieg erlaubte es Fleming, Howard Florey und Ernst Chain die Wirksamkeit des ersten Antibiotikums so eindrucksvoll zu demonstrieren, dass ihnen 1945 der Nobelpreis verliehen wurde.
Ein einfach zu wiederholendes Experiment, was ich zufällig in meinem Kühlschrank bestätigt sah. (Ich hab‘ nicht extra danach suchen müssen) Fleming unterzog die Zell-Kulturen einer eingehenden Untersuchung, wobei sich herausstellte, dass der Pilz, penicillinum notatum, die Zellwände der Bakterien zerstört und damit die Ausbreitung der Bakterien verhindert hatte. Es ist wohl wahrscheinlich, dass Fleming die Ergebnisse von Ernest Duchesne kannte, der bereits 1897 in seiner Doktorarbeit unter anderem die Wechselwirkung zwischen E.coli und Penicillinum glaucum untersucht hatte. Er konnte schon damals die antimikrobielle Wirkung des Pilzes auf Bakterien-Kulturen und mit Typhus infizierten Tieren nachweisen. Der Eintritt ins Militär und eine tödliche Tuberkulose-Infektion verhinderten eine frühere Identifikation des Wirkstoffes. Fleming hingegen gelang der Nachweis, dass ein Produkt des Pilzes für die bakterizide Wirkung verantwortlich war, das er nach dem Schimmelpilz Penicillin benannte. Gleichwohl sollte es weitere 10 Jahre dauern, ehe es gelang aus dem Wirkstoff ein wirkungsvolles Medikament in industriellem Maßstab zu gewinnen. Der II. Weltkrieg erlaubte es Fleming, Howard Florey und Ernst Chain die Wirksamkeit des ersten Antibiotikums so eindrucksvoll zu demonstrieren, dass ihnen 1945 der Nobelpreis verliehen wurde.
Die goldenen Jahre
Der Entdeckung des Penicillins folgten in kurzen Abständen die Sulphonamide, das erste Breitband-Antibiotikum Tetracycline, Streptomycin, Chloramphenicol und die Makrolid-Antibiotika, namentlich Erythromycin. Damit standen in den 60er und 70er Jahre eine Vielzahl wirkungsvoller Antibiotika für praktisch jede bakterielle Infektion zur Verfügung, so dass William H. Stewart, US Surgeon General, 1969 dem amerikanischen Kongress mitteilte: „The time has come to close the book on infectious disease.“
Die Mahnungen einiger weniger Wissenschaftler wie Fleming, der bereits 1946 vor Resistenzen als Folge falscher und unsachgemäßer Verwendung von Penicillin gewarnt hatte, waren längst vergessen.
Verwendung nicht nur gegen bakterielle Infektionen
Entgegen landläufiger Meinung werden Antibiotika aber nicht primär zur Bekämpfung bakterieller Infektionen eingesetzt. Das Anwendungsspektrum ist so weit gefächert, dass eine erschöpfende Aufzählung kaum möglich ist, mit Abstand am häufigsten werden Antibiotika jedoch in der Landwirtschaft, speziell den Mastbetrieben, verwendet. Bereits in den vierziger Jahren hatte man erkannt, dass Antibiotika aus weitgehend ungeklärten Gründen das Wachstum beschleunigen, insbesondere in der Massentierhaltung, da hier die prophylaktische Verabreichung von Antibiotika gleichzeitig Infektionen unterdrückt. Aus eben diesem Grund werden Flussläufe und Seen mit Antibiotika überflutet, um die Zucht von Lachsen, Gambas oder Shrimps ertragreicher zu gestalten. Obwohl die Schätzungen auch aufgrund fehlender oder hinreichend präziser Daten weit gestreut sind, kann man davon ausgehen, dass weltweit etwa 50-80% der Antibiotika für nicht-therapeutische Zwecke verwendet werden. Dänische Studien haben belegt, dass der Nutzen jedoch ausserordentlich begrenzt ist: der Masse-Gewinn bei Antibiotika-gestützter Tierhaltung beläuft sich auf nur etwa 4-5% [1].
Der Haken: Starke Zunahme von Resistenzen
Ein Nebeneffekt der breit gestreuten Verwendung von Antibiotika in der Tier- und Fischzucht ist die Kontamination der Umgebung mit Spuren von Antibiotika. Man findet nachweisbare Konzentrationen von Antibiotika in der näheren Umgebung von Mastbetrieben in den Gewässern, im Grundwasser und auf den Feldern, wo die Antibiotika für eine vergleichsweise lange Zeit ihre Aktivität erhalten. Als Konsequenz werden die Mikroorganismen in dieser Umgebung permanent einer Konzentration antimikrobieller Wirkstoffe ausgesetzt, die nicht ausreicht die Organismen zu töten, aber einen kontinuierlichen Selektionsdruck ausübt. Ob und inwieweit dies Auswirkungen hat, ist noch völlig unklar.
Dem größten Selektionsdruck werden die Mikroorganismen mit Sicherheit in Krankenhäusern ausgesetzt sein. Als unmittelbare Konsequenz sind Krankenhäuser, oder vielmehr deren Patienten, die häufig ein geschwächtes Immunsystem aufweisen, auch primär betroffen von dem massiven Auftreten von Bakterienstämmen, die gegen verschiedene Antibiotika resistent sind. Dies sind besonders die Staphylococcus aureaus Bakterien, von denen typisch etwa 70-90% aller Stämme resistent gegen mehrere der gebräuchlichen Antibiotika sind [2,3]. Besonders virulent sind dabei jene Stämme, die sowohl gegen Methicillin als auch Vancomycin resistent sind. Das Auftreten von Vancomycin-resistenten Stämmen ist Besorgnis erregend, da dies Antibiotikum als das letzte universell einsetzbare galt.
Die Gefahren und auch die damit verbundenen Kosten bakterieller Resistenzen sind nicht zu unterschätzen: eine Studie von 1995 belegt, dass allein in New York jährlich etwa 1.500 Todesfälle auf solche Staphylococcus aureaus Infektionen zurückzuführen sind, Tendenz steigend [4].
Um also neue, wirkungsvolle Antibiotika zu entwickeln, um der rapiden Ausbreitung der bakteriellen Resistenzen Herr zu werden, ist es essentiell die Mechanismen, die der Wirkungsweise der Antibiotika und ebenso den Resistenzen gegen diese zugrunde liegen, im Detail zu verstehen.
Übersicht und Wirkungsweise:
Antibiotika, natürliche Resistenzen
Als Antibiotika wurden ursprünglich Wirkstoffe definiert, die von Mikroorganismen produziert werden um andere Organismen in ihrer Entwicklung zu hemmen oder ultimativ zu töten.
Die allermeisten Antibiotika sind entweder natürliche Wirkstoffe, oder chemisch modifizierte Varianten dieser Wirkstoffe.
Die Mikroorganismen, die diese antimikrobiellen Wirkstoffe produzieren, müssen also einen Mechanismus besitzen, um sich selbst gegen die antimikrobielle Wirkung zu schützen, also resistent sein.
Man kann im wesentlichen drei Mechanismen unterscheiden:
- die Inaktivierung des Wirkstoffes
- die Modifikation des Angriffspunktes
- den schnellen Transport des Wirkstoffes aus der Zelle
Diese drei Mechanismen sind sowohl für die produzierenden als auch für resistente Organismen weit verbreitet. Es scheint so, als ob für jedes zumindest natürliche oder semi-synthetische Antibiotikum bereits ein Resistenz-Mechanismus existiert.
Grundarten der Wirkungsweise von Antibiotika:
Die Wirkungsweise der Antibiotika lassen sich grundsätzlich und unabhängig von den Angriffspunkten ebenfalls in drei verschiedene Gruppen einteilen, wobei manche Antibiotika mehr als einer Gruppe zugeordnet werden können:
- Antibiotika die ein funktionelles Zentrum eines Enzyms blockieren
- Antibiotika die durch molekulare Mimikry die Bindungsstelle aber nicht die Funktion eines physiologisch wichtigen Zellbestandteiles übernehmen.
- Antibiotika die eine spezifische, aber physiologische Konformation induzieren.
Angriffsziele:
Um eine antimikrobielle Wirkung zu erzielen, muss ein Wirkstoff ein zentrales Element des Stoffwechsels des zu attackierenden Organismus angreifen können. Je universeller der Aufbau des Targets ist, desto breitbandiger wirkt das Antibiotikum. Als Angriffspunkte der Antibiotika eignen sich also unter anderem
- die Zellwand
- RNA- oder DNA-Polymerasen
- Peptid-Deformylasen
- Protein-Biosynthese
und viele mehr.
Penicillin, Methicillin oder Vancomycin unterbinden den Aufbau der Zellwand, indem sie letztlich die Transpeptidasen blockieren, jene Enzyme, die die Polysaccharid-Ketten aus denen die Zellwand aufgebaut wird, miteinander verknüpfen. Dadurch zerfällt die Zellwand und die angegriffenen Bakterien werden zerstört. Penicillin wirkt also bakterizid.
RNA-Polymerasen sind verantwortlich für den Aufbau der RNA-Stränge, wie dies z.B. bei dem Kopieren der DNA-Information auf die mRNA erfolgt. Antibiotika wie Rifampicin heften sich direkt an die RNA-Polymerasen und deaktivieren diese. Der Stoffwechsel der angegriffenen Zelle kommt zum Stillstand, so dass diese Antibiotika also in erster Linie bakteriostatisch wirken.
Die Protein-Fabrik
Die Protein-Biosynthese ist eines der wichtigsten Angriffsziele antimikrobieller Wirkstoffe. Tatsächlich greifen die meisten der neu entwickelten Antibiotika genau diesen komplexen Prozess an.
Im Rahmen der Protein-Biosynthese wird der genetische Code, dessen Kopie von der mRNA abgelesen wird, in den Aufbau von Proteinen umgesetzt. In diesem Prozess werden also alle Proteine, das heisst alle Enzyme und aktiven Komponenten des Stoffwechsels, produziert. Eine Unterbrechung der Protein-Biosynthese ist daher in jedem Fall das sichere Ende eines Organismus.
Die Übersetzung des genetischen Codes und der Aufbau der Proteine wird durch die universelle Proteinfabrik der Zelle, das Ribosom, vollführt. Diese Universalität macht das Ribosom zu einem besonders interessanten Target für das Antibiotikum wie die Wissenschaft gleichermaßen.
Viele Teilprozesse der Protein-Biosynthese sind virtuell identisch für die meisten prokaryontischen Organismen, aber zum Teil auch für höhere Organismen wie die menschliche Zelle.
Edeine oder Sparsomycin sind solche Wirkstoffe, die an universell konservierten Bereichen des Ribosoms binden, und somit die Protein-Biosynthese in jedem Organismus blockieren. Die Folge sind erhebliche Nebenwirkungen, so dass diese Wirkstoffe nicht als Antibiotika sondern eher als Anti-Tumor-Wirkstoffe eingesetzt werden.
Wirkungsweise am Ribosom:
Das Ribosom ist ein Ribonukleoprotein-Komplex, der sich aus zwei verschiedenen Untereinheiten zusammensetzt (Details in: Struktur).
Im Rahmen der Protein-Biosynthese (eine weitere Beschreibung in: Funktion) müssen die beiden Untereinheiten einen sogenannten Initiationskomplex bilden, an dem neben der mRNA, der Initiator-tRNA auch drei verschiedene Initiationsfaktoren (IF) beteiligt sind.
Dies ist ein Prozess der durch Antibiotika wie Edeine oder Pactamycin angegriffen wird: Edeine fixiert eine spezifische Konformation der 30S Untereinheit, so dass die Prozessierung der Shine-Dalgarno-Sequenz der mRNA und die Positionierung des Initiationsfaktors IF3 gestört wird. Der Initiationskomplex kann also nicht gebildet werden und die Protein-Biosynthese kommt zum erliegen.
Nach der Bildung des 70S-Initiationskomplexes durchläuft die Protein-Biosynthese einen zyklischen Prozess, den Elongations-Zyklus, an dem verschiedene Elongationsfaktoren und die tRNA-Moleküle beteiligt sind.
Die tRNAs transportieren die Aminosäuren, aus denen das Protein zusammengesetzt wird, zum Ribosom.
Das Ribosom gewährleistet mit erstaunlicher Präzision und Geschwindigkeit, dass nur solche tRNA-Moleküle ihre Aminosäure abgeben dürfen, die dem Codon auf der mRNA entsprechen. Die Elongationsfaktoren wiederum sind für den Positionierung der tRNA auf dem Ribosom, beziehungsweise die synchrone Verschiebung der mRNA und der assoziierten tRNA durch das Ribosom zuständig. Wesentlich ist dabei die Wechselwirkung der Elongationsfaktoren mit der GTPase assoziierten Region (GaR) des Ribosoms.
Antibiotika wie Thiostrepton oder Microccocin binden an die 23S rRNA der GaR und unterbinden dadurch die Elongation durch den Elongationsfaktor EF-G.
Kirromycin oder Aurodox hingegen fixieren die Konformation des Elongationsfaktors EF-TU, so dass EF-TU das Ribosom nicht mehr verlassen kann. Dadurch wird das Ribosom in einem Haltezustand fixiert.
Antibiotika wie Sparsomycin oder Linezolid wirken auf eine ähnliche Art: sie binden an die 23S rRNA und erhöhen dadurch die Affinität für die tRNA, so dass diese in ihrer Position im Ribosom fixiert werden, und damit die Translokation, also die Verschiebung der mRNA/tRNA auf dem Ribosom unterbunden wird.
Das Ende des Elongations-Zyklus wird durch ein Stop-Codon auf der mRNA signalisiert und durch verschiedene Terminations- und Recycling-Faktoren realisiert.
Jeder dieser Schritte der Protein-Biosynthese ist ein geeignetes Ziel für antimikrobielle Wirkstoffe und tatsächlich findet man zu fast jedem Schritt der Protein-Biosynthese mindestens einen Inhibitor.
Ribosomaler Tunnel und Makrolid-Antibiotika:
Wenn das Ribosom ein neues Protein synthetisiert, dann liegt dieses Protein zunächst als weitgehend ungefaltete, linear Polypeptidkette vor, und böte damit eine Angriffsfläche für Proteasen. Um diese Polypeptidkette also vor der vorzeitigen Zerstörung zu schützen, wird sie durch einen etwa 100Å (1Å=0.1nm) langen und etwa 15Å weiten Tunnel geschleust.
Dieser Tunnel zieht sich von dem Peptidyltransferase-Zentrum, wo die Peptidkette gebildet wird, bis zum Boden der 50S ribosomalen Untereinheit. Verschiedene Enzyme kooperieren dort mit dem Ribosom, um die Polypeptid-Kette in ihre korrekte, funktionelle Form zu bringen.
Biochemische Experimente haben gezeigt, dass irgendwo in diesem Prozess die Makrolide-Antibiotika angreifen, ohne dabei direkt in den Zyklus der Protein-Biosynthese einzugreifen. Diese Klasse der Antibiotika binden an einem spezifischen Bereich der 50S Untereinheit, dem Peptidyl-Transferase-Ring (PTR), wo sie das Ribosom erst nach einigen Elongationszyklen blockieren. Das heisst, das ein Ribosom eine Proteinkette mit 4-6 Aminosäuren aufbauen kann, bevor die Makrolide die Protein-Biosynthese zum Stillstand bringen.
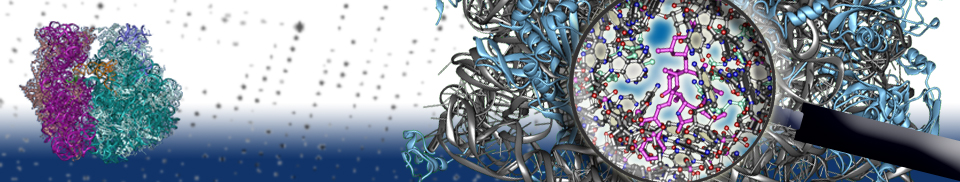
 Erythromycin blockiert den Tunnel durch den die Kette von Aminosäuren (also das ‚rohe‘ Protein) das Ribosom geziehlt verläßt. Erythromycin rot, 5S-RNA in Blau, 23S-RNA blaumetallic und Proteine in Gold.
Erythromycin blockiert den Tunnel durch den die Kette von Aminosäuren (also das ‚rohe‘ Protein) das Ribosom geziehlt verläßt. Erythromycin rot, 5S-RNA in Blau, 23S-RNA blaumetallic und Proteine in Gold.
Die Makrolide bestehen im Prinzip aus einem immer gleichen Grundgerüst: einem Lactone-Ring, der zumeist 14, 15 oder 16 Glieder umfasst, einem Desosamine-Zucker und verschiedenen Gruppen, die die Bindung stabilisieren sollen (Abbildung unten). Die Unterschiede im Aufbau der verschiedenen Makrolide führen zu leicht unterschiedlichen Wechselwirkungen mit dem Ribosom. Allen gemeinsam ist aber die Bedeutung des Desosamine-Zuckers für die Bindung der Makrolide.

Erythromycin und viele der semi-synthetischen Derivate besitzen eine zweite Zuckergruppe, die Cladinose. Lange Zeit glaubte man, dass diese Gruppe für die Bindung essentiell ist, die Strukturen der 50S-Makrolide-Komplexe zeigen jedoch, dass die Cladinose nur wenige hydrophobische Wechselwirkungen mit der ribosomalen RNA aufweist, und für die Stabilität der Bindung vergleichsweise unbedeutend ist.
Neuere Ketolide, semi-synthetische Abkömmlinge der Makrolide, kommen daher ohne die Cladinose aus, und haben zum Teil dennoch eine stärkere Bindung an die 23S rRNA, was anhand der spezifischen Wechselwirkungen verständlich wird. Die Resistenz-Mechanismen, soweit sie auf Modifikationen der Makrolide oder des Ribosoms basieren, lassen sich ebenfalls durch die Analyse der Wechselwirkungen zwischen Antibiotikum und Ribosom verstehen.
Makrolid-Antibiotika und Resistenzen: RNA Mutationen
Die Bindungsstelle der Makrolide beinhaltet nur einige wenige Basen der 23S rRNA, jede dieser Wechselwirkungen ist daher essentiell für die Effizienz des Antibiotikums.
Viele Resistenzen gegen Makrolide basieren daher auf der Modifikation der Bindungsstelle. Dies sind entweder Mutationen der Basen im PTR oder die Methylierung einer einzigen Base: A2058.
Die Folgen der Methylierung sind offensichtlich: die Desosamine-Gruppe verliert durch diese Modifikation die wichtigen Wasserstoff-Brücken, die Bindung an die ribosomale rRNA wird deutlich geschwächt.
Zum anderen verhindert der sterische Effekt die Positionierung von Erythromycin.
Andere Mutationen wie A2058G, A2059G oder C2610U wirken prinzipiell ebenso.
Generell findet man fast eine eins-zu-eins Korrelation zwischen den Bindungsstellen der Makrolide und den Resistenz-Mutationen der 23S rRNA. A2058 ist in praktisch allen bakteriellen Organismen konserviert, in Eukaryonten oder Mitochondrien findet sich hingegen ein Guanine anstelle des Adenins. Dies ist vermutlich der Grund warum Makrolide vergleichsweise weni g Nebenwirkungen zeigen: wir sind von Natur aus resistent.
Die Methylierung von A2058, einer Base die praktisch in allen bakteriellen Organismen konserviert ist, ist allerdings eine spezielle Modifikation, da sie nicht nur Resistenzen gegenüber Makroliden, sondern zwei weiteren Klassen von Antibiotika führt, den Lincosamiden und Streptogramin B, der sogenannten MLSB-Resistenz. Diese Antibiotika besitzen alle überlappende Bindungsstellen, die das besagte A2058 als wesentliche Komponente enthalten, so dass diese Art der Resistenz ein ausserordentlich effizienter Weg der Bakterien ist, sich gegen ein breites Spektrum verschiedener Antibiotika zu immunisieren.
Ketolide wie ABT-773 oder Telithromycin können einen Teil der Resistenzen durch Wechselwirkungen kompensieren, die durch Modifikationen am Lactone-Ring gewonnen werden. ABT-773 zum Beispiel verfügt über eine Quinolyl- sowie eine Carbamate-Gruppe, die andere Regionen der 23S rRNA mit in die Bindung einbeziehen.
Die Wechselwirkungen involvieren primär das Rückgrat der rRNA-Basen, was zur Folge hat, dass die Bindungen weniger empfindlich gegen Mutationen sind.
Azalide wie Azithromycin erzielen ihre bessere Wirkung hingegen primär durch bessere pharmakokinetische Eigenschaften. Durch das Einfügen der Azo-Gruppe in den Lactone-Ring wird der hydrophobe Charakter des Lactone-Rings aufgehoben, so dass diese Antibiotika eine deutlich bessere Wirkung bei gram-positiven Erregern erzielen.
Azithromycin zeichnet sich weiterhin durch eine wesentlich bessere Akkumulation aus, so dass man mit einer einzigen Dosis dieses Antibiotikums eine Wirkung erzielen kann, wie eine einwöchige Therapie mit Erythromycin.
Die Azo-Gruppe selbst ist kaum in die Bindung des Wirkstoffes involviert, wiewohl der 15-gliedrige Ring zusätzliche hydrophobische Wechselwirkungen aufweist, und damit zu einer Stabilisierung der Bindung im Vergleich zu Erythromycin führt.
Makrolid-Antibiotika und Resistenzen: Protein Mutationen
Obwohl die Makrolide als auch andere Antibiotika wie Chloramphenicol oder Clindamycin ausschliesslich in Wechselwirkung mit der rRNA treten, gibt es im Falle der Makrolide verschiedene Resistenz-Mechanismen, die durch Mutationen ribosomaler Proteine induziert werden.
Mutationen in den ribosomalen Proteinen L4 oder L22 führen zu Makrolide-resistenten Bakterienstämmen, obwohl die Makrolide-Antibiotika nicht direkt in Kontakt mit den ribosomalen Proteinen stehen. Es ist nicht endgültig geklärt, wie diese Mutationen eine Resistenz gegen Makrolide induzieren können, anhand der Kristall-Struktur der 50S ribosomalen Untereinheit kann man aber zumindest eine partielle Antwort geben.
Beide Proteine binden und organisieren die rRNA-Stränge, an denen die Makrolide binden. Die Mutationen der ribosomalen Proteine werden also vermutlich zu Modifikationen in der Faltung der rRNA führen, und daher die Bindung der Makrolide zumindest behindern.
Die Resistenz, basierend auf Mutationen der ribosomalen Proteine, ist allerdings ein eher schwach populierter Resistenz-Mechanismus, da die Resistenz nur zu einer reduzierten Empfindlichkeit gegenüber den Makroliden führt. Sonst hätte man erwarten dürfen, dass dieser Resistenz-Mechanismus sehr viel dominanter ausgeprägt wäre.
Ribosomale Proteine bakterieller Organismen sind in der Regel in einer einzigen Kopie auf den Chromosomen kodiert, so dass bereits eine einzelne Mutation den Erreger Resistenz machen kann, wohingegen die meisten Bakterien mehrere Kopien, auf denen die rRNA kodiert ist, besitzen. Resistenz-Mutationen der rRNA müssen also simultan mehrere Kopien der rRNA betreffen, was entschieden schwieriger zu bewerkstelligen ist.
RNA-World ??
Die Evolution hat offensichtlich solche antimikrobiellen Wirkstoffe favorisiert, die langfristig einen Vorteil für die erzeugenden gegenüber konkurrierenden Organismen bedeuten. Daher binden praktisch alle natürlichen (und folglich semi-synthetischen) Antibiotika an der rRNA nicht jedoch an ribosomalen Proteinen.
Aus eben diesem Grunde sind vermutlich zumindest die meisten funktionalen Zentren des Ribosoms ausschliesslich aus rRNA aufgebaut. Das Peptidyl-Transferase-Zentrum (PTZ) ist das eigentliche funktionale Zentrum der 50S ribosomalen Untereinheit. Hier werden die Aminosäuren zu einer Polypeptidkette verknüpft, aus dem später das Protein gefaltet wird.
Wie dieser Prozess im Detail abläuft ist immer noch eine offene Frage, aber zumindest ist anhand der Kristallstruktur erkennbar, dass an diesem Prozess ausschliesslich rRNA beteiligt ist. Dies macht das PTZ zu einem primären Target vieler antimikrobieller Wirkstoffe wie zum Beispiel Chloramphenicol, Clindamycin oder Puromycin.
Die drei Antibiotika binden direkt in der Position, in der die tRNA die Aminosäure positionieren würde. Es ist eine Art molekularer Mimikry: die Antibiotika wirken wie eine tRNA-gebundene Aminosäure. Dadurch binden diese Antibiotika mit hoher Affinität im PTZ, und verhindern so die Bildung der Peptid-Bindung.
Das PTZ ist allerdings ein phylogenetisch hochgradig konservierter Bereich des Ribosoms, der in Eukaryonten sehr ähnlich organisiert ist. Aufgrund dessen haben Antibiotika wie Chloramphenicol nicht unerhebliche Nebenwirkungen, so dass dies Antibiotikum nur noch vergleichsweise selten in der Behandlung bakterieller Infektionen verwendet wird.